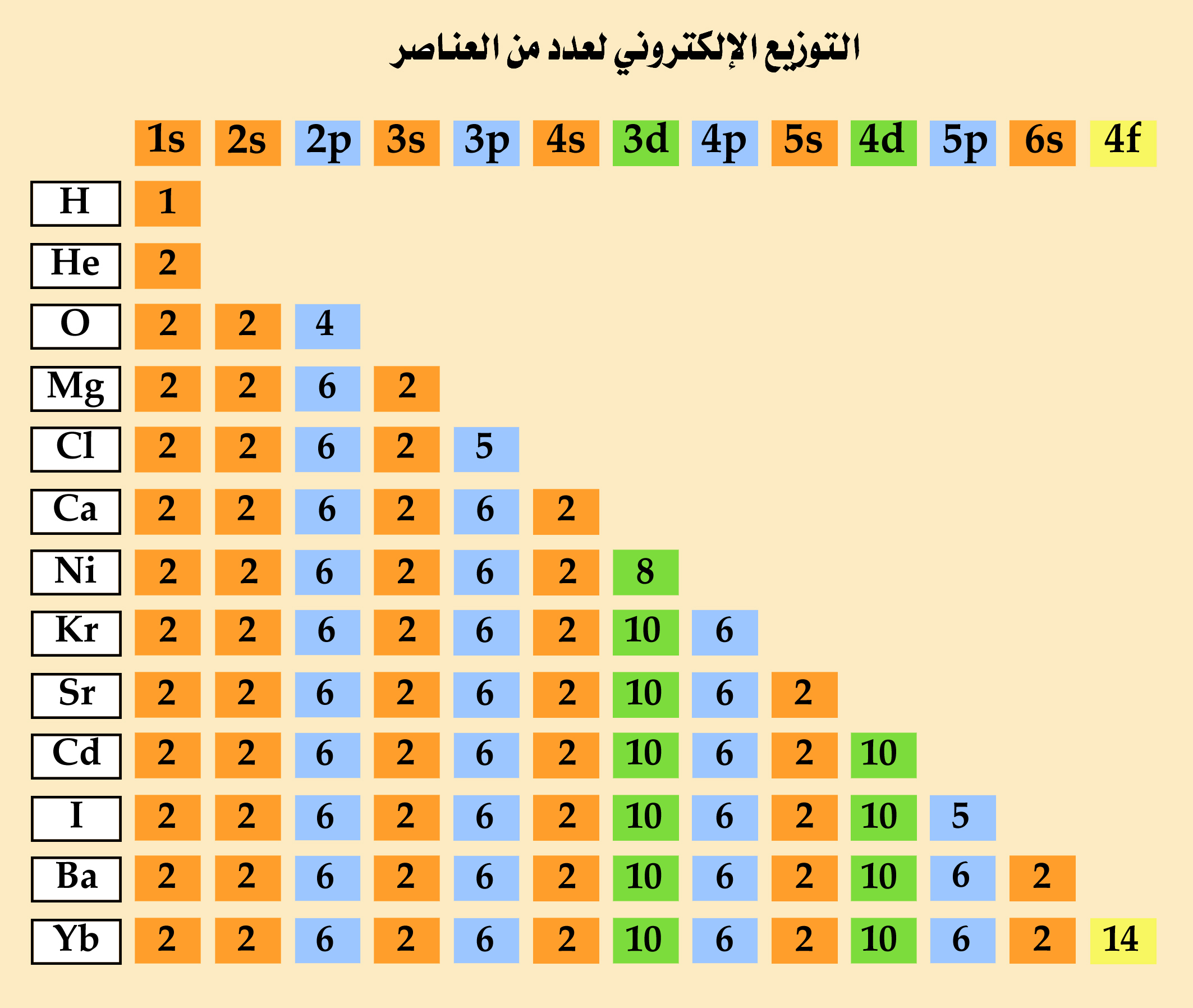
تتميز العناصر بوجود مدارات وهمية تدور فيها الإلكترونات المرتبط بالذرة حول النواة، ويطلق على هذه المدارات اسم مستوى الطاقة.
وقد بحث طلاب المراحل المتوسطة عن إجابة سؤال ورد في كتاب العلوم يتحدث عن التوزيع الإلكتروني في مدارات العناصر.
وسنشرح لكم عبر موقع السعودية اليوم إجابة السؤال مع تقديم العديد من الامثلة حول توزيع الإلكترونات في مجالات الطاقة.
السؤال هو:
رتب إلكترونات مجال الطاقة الأول، والثاني، والثالث لذرة الصوديوم من الداخل إلى الخارج؟
في البداية سنتعرف على التوزيع الإلكتروني ولماذا يستخدم وطريقة توزيع الإلكترونات في المجال.
التوزيع الإلكتروني:
التوزيع الإلكتروني هو توزيع إلكترونات العنصر في مجال الذرة، ويبنى التوزيع الإلكتروني على ثلاث حقائق هي:
في الفراغ الضيق للجزئ.
تعد الإلكترونات فرميونات وبالتالي تطبق مبدأ لا يشغل اثنين من الفرميونات نفس الكمية.
الإلكترونات غير مستقرة عندما يشغل مستواه غير أصلى.
طريقة التوزيع الإلكتروني:
يتسع المدار الأول 2 من الإلكترونات.
المدار الثاني: 8 إلكترونات.
الثالث : 18 إلكترون.
الرابع: 32 إلكترون.
الخامس: 50 إلكترون.
السؤال:
رتب إلكترونات مجال الطاقة الأول، والثاني، والثالث لذرة الصوديوم من الداخل إلى الخارج؟..
الإجابة هي:
المستوى (ن): عدد الالكترونات 2 ن اس 2 : العدد الذري للصوديوم هو 11 والتوزيع الإلكتروني كالتالي:
الأول ن= 2
الثاني ن= 8
الثالث = 1
إلى هنا نصل وإياكم لختام المقال الذي شرح لكم طريقة توزيع إلكترونات العناصر، شكرا لكم للمتابعة.