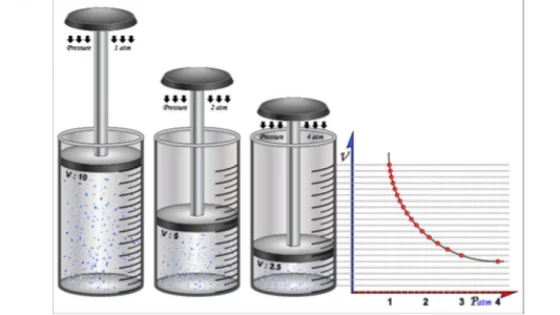
حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.، يُعتبر قانون بويل الفيزيائي واحدًا من أهم القوانين التي أحدثت فرقًا في العديد من التطبيقات الحياتية. سنتناول في هذا المقال عبر موقع السعودية اليوم اجابة سؤال حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته، تابع المقال.
حساب حجم الغاز في الشرطين النظاميين
يمكن حساب حجم أي غاز في الشرطين النظاميين (درجة حرارة الغرفة والضغط الجوي) باستخدام قانون بويل. وفقًا لقانون بويل، يكون المنتج بين ضغط الغاز (P) وحجمه (V) ثابتًا عند الشرطين النظاميين، وذلك في حالة أن العدد المولي للغاز (n) ودرجة الحرارة (T) ثابتان.
يمكن تعبير ذلك بالمعادلة التالية:
P₁V₁ = P₂V₂
حيث:
P₁ هو الضغط الأولي (الضغط الجوي)
V₁ هو الحجم الأولي (الحجم المطلوب حسابه)
P₂ هو الضغط النهائي (الضغط الجوي)
V₂ هو الحجم النهائي (حجم المولات المطلوب حسابه)
ووفقًا للمعطيات التي ذكرتها، يتم ضرب عدد المولات بواحدة المولية بـ 24 لترًا. وبالتالي، يمكن استخدام هذا العدد كقيمة V₂.
مثال:
فلنفترض أن لدينا 4 مولات من غاز ما. بناءً على العبارة التي قدمتها، سنكون بحاجة إلى حساب حجم هذه المولات.
V₂ = عدد المولات × 24 لترًا
= 4 مول × 24 لترًا
= 96 لترًا
شاهد ايضا: اصطدمت كرة بلياردو بيضاء تصادما مرنا بكرة آخرى ساكنة، الملاحظة
حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.
عبارة صحيحة.